 |
 |
| |
| 清原 洋太 |
(一社)浄化槽システム協会講師団 |
(月刊浄化槽 2020年11月号) |
|
 |
| |
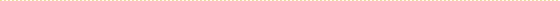 |
|
1.はじめに
浄化槽は主に微生物の働きによって生活排水を処理しており、処理性能の向上や安定化には、微生物の機能を理解することが重要となる。しかし、戸建て住宅に設置された浄化槽において微生物の機能を解析・評価することは容易ではない。その原因は、浄化槽へ流入する原水の性状や水量が物件毎に異なり、純粋に比較できないことにある。また従来は、微生物を顕微鏡観察して評価することが多かったが1)、排水処理で重要となる細菌の観察・評価は困難である。特に近年は窒素除去型浄化槽が主流となっており、生物学的硝化・脱窒、つまり硝化反応や脱窒反応に直接関与する微生物は細菌であると考えられている。ここでは、窒素除去の中でも律速となる硝化に関与する硝化細菌の解析・評価について紹介する。 |
| |
 |
 |
| 2.生物解析手法を用いた硝化性能の評価について |
2.1 実験目的
微生物による硝化反応はアンモニア態窒素(NH4-N)を亜硝酸態窒素(NO2-N)及び硝酸態窒素(NO3-N)に変換する反応である。そのため、硝化を評価する場合はNH4-N、NO2-N、NO3-Nを測定するが、それは生物学的硝化の結果を確認していることになる。今回の実験では、浄化槽において硝化に機能する硝化細菌の実態を調査することを目的とした。具体的には、13℃と25℃で運転している浄化槽の処理性能と、それぞれの槽における硝化細菌の量と細菌叢(菌の種類)について解析し、水温による硝化細菌への影響について考察した。 |
| |
|
2.2 実験装置と方法
前述のように、戸建て住宅に設置された浄化槽は流入条件が物件毎に異なるため、詳細な生物評価には適さない場合もある。そこで、実際の生活排水でありながら、ある程度均一な流入水質が得られる実験施設にて実験的検討を行った(図1)。実験施設では集合住宅からの排水を施設内の原水槽に汲み上げ、その原水槽から各実験槽に流入させることができる。各戸からの排水が混合されることでバラツキが低減し、標準的な生活排水になることが期待される。実験期間中の原水平均濃度と標準偏差はBOD: 196±17 mg/L(n: 7)、T-N:45±10 mg/L(n:19)となり、概ね一般的な生活排水の濃度で安定していた。
 |
| 図1 実験施設の概要図 |
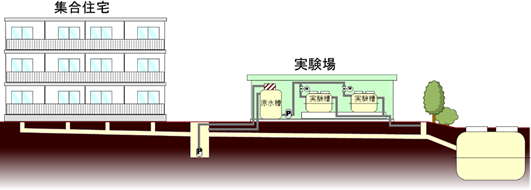
実験システムは1)嫌気槽、2)好気槽、3)沈殿槽から構成されるミニスケールの実験槽を用いた(図2)。システムの総滞留時間は43hrと、コンパクト型浄化槽程度に設定した。1)嫌気槽、2)好気槽には、実際の浄化槽に充填されるろ材をそれぞれ充填し、好気槽には散気管を設け、ばっ気してDOを5mg/L以上に制御した。流入条件については、槽内の状況を安定させるために、常時均等流入とした。このシステムを2系列設置して13、25℃にそれぞれ制御し、放流水質の確認および好気槽の生物解析を行った。
 |
| 図2 実験システムの概要図 |
|
| |
|
2.3 生物解析手法
生物解析は、浄化槽における窒素除去で律速となることの多い硝化に機能する硝化細菌(アンモニア酸化細菌)を対象とした。上記のように細菌は顕微鏡での解析が難しいため、遺伝子解析を用いた2)。遺伝子解析では、硝化が行われる好気槽の生物膜からDNAを抽出して解析した。抽出したDNAは、様々な生物のDNAが混合するメタゲノムとよばれ、その中で硝化細菌(アンモニア酸化細菌)のみに存在するamoA遺伝子を解析した3)。amoA遺伝子を解析することで、多様な生物の中で「硝化細菌」に絞って解析・評価することが可能となる。
今回用いたリアルタイムPCRは、目的とする遺伝子の「量」を定量する手法である。つまりamoA遺伝子を対象としたリアルタイムPCR解析を行うと、硝化細菌の量を評価できる。またPCR-DGGEは、遺伝子の「種類」を評価する手法である。つまりamoA遺伝子を対象としたPCR-DGGEを行うと、硝化細菌の種類(硝化細菌叢)を評価できる。さらにクローン解析は、DNA配列を決定してデータベースと照会し、硝化菌の種類を決定することができる。 |
| |
|
2.4 結果と考察
上記の実験システムを13、 25℃に制御して133日間運転した(図1、2)。実験期間における放流水のBOD、T-N、NH4-N、NOx-Nを図3に示した。
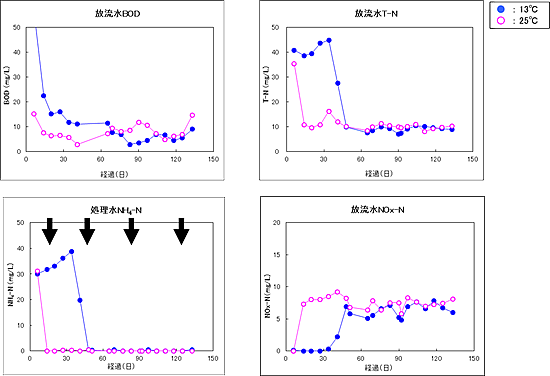 |
| 図3 放流水のBOD、 T-N、 NH4-N、 NOx-N |
| ※NH4-Nの矢印は生物解析のタイミング(15、 48、 83、 125日) |
BODについては13℃槽に比べて25℃槽での立ち上がりが早かったが、20日目以降は両系列とも20mg/L以下となった。T-Nについて25℃槽では開始10日程度で10mg/L程度まで低下し、実験終了まで安定に推移した。一方13℃槽では開始30日程度まで40mg/L程度で推移して処理が進まなかったが、その後急激に低下し10mg/L程度となり、25℃槽と同程度となった。NH4-NはT-Nとの相関が高く、25℃槽では10日以降、13℃槽では30日以降に急激に低下し、ほぼ検出されなかった。NOx-Nについては硝化が立ち上がってNH4-Nが低下したタイミングでそれぞれ検出され、その後は5〜10mg/L程度で推移した。
このように、窒素除去については硝化の影響が大きく、水温によって硝化の立ち上がりに要する期間に差がみられた一方で、立ち上がり後の性能は概ね同等となった。これまでの解析からも、水温等の環境条件によって浄化槽で機能する生物が変化することが示されているが4)、5)、この実験において機能している生物について、特に硝化細菌に着目して解析を行った(図4)。
| <リアルタイムPCR> 硝化細菌(amoA遺伝子)の量を調査 |
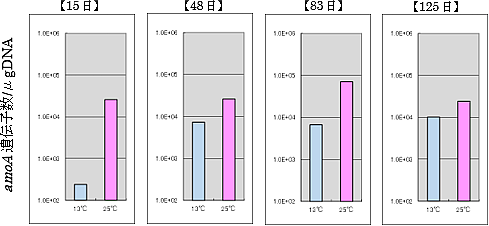 |
| |
<PCR-DGGE> 硝化細菌(amoA遺伝子)の種類を調査
1種類の硝化細菌が1つのバンドとしてゲル上に検出される |
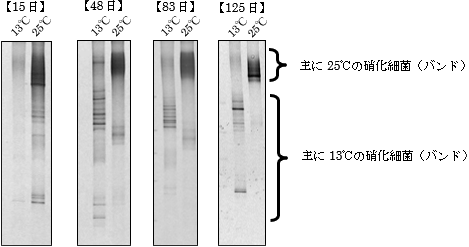 |
| 図4 硝化細菌(amoA)解析 |
リアルタイムPCRによって、好気槽生物膜から抽出したDNAのamoA遺伝子を定量した。15日目には、硝化が進んでいない13℃槽において1.0E+2程度で、20℃槽の1.0E+4と差がみられた。13℃槽では、硝化細菌の増殖が遅いために硝化の立ち上がりに時間を要したと考えられる。一方で13、 25℃両槽で硝化が進行した48日目以降は、amoAの差が小さくなっていた。それぞれの槽で硝化細菌が増殖し、硝化が進行したと考えられる(図3、4)。
amoA遺伝子を対象としたPCR-DGGEによる硝化細菌の解析では、15日目には25℃槽でバンド(硝化細菌)が検出されているが、13℃槽では検出されなかった。15日目の13℃槽では硝化細菌が少なかったと考えられ、リアルタイムPCRの結果とも合致した。13、25℃の両槽で硝化が進行した48日目以降は、それぞれバンドが検出された。しかし図4のように、13℃槽では主にゲルの下側に複数のバンドが検出されているが、25℃槽では主にゲルの上側にバンドが検出されており、これは水温によって存在する硝化細菌の種類が異なることを示している。各水温のサンプルを対象にamoA遺伝子のクローン解析を行ったところ、13℃槽では多様な硝化細菌が検出された一方、25℃槽では限られた硝化細菌のみが検出された。これは図4のPCR-DGGEと合致する結果と考えられる。 |
| |
|
2.5 まとめ
生物解析によって、処理に機能している生物の実態を解析することができた。まず、水温が硝化細菌の増殖に影響することが示された。25℃槽に比べて13℃槽の硝化細菌の増殖が遅いことは、硝化の立ち上がりに時間を要した処理性能と合致する結果だった。また一般に、低水温であると硝化の立ち上がりに時間を要することとも合致する結果といえる。さらに今回の結果においては、水温によって機能している硝化細菌の種類が変化していた。これより、13、25℃それぞれの環境条件に適した硝化細菌が増殖、機能して、窒素除去が進んでいると考えられる。硝化性能を向上・安定化するためには、それぞれの環境条件に適した硝化細菌を保持することが重要と考えられる。 |
| |
 |
|
 |
3.おわりに
今回紹介した解析結果は限られた条件での事象であり、実際には水温以外の様々な環境条件も生物処理に影響する。例えば排水の濃度や組成、流入水量、流入パターン等が影響すると考えられる。それらの影響についても生物解析を使って評価することで、「生物がどのように処理しているか」というメカニズムを考察することが可能になると期待される。今後も生物解析によって、生物処理についての理解を深めていくことは、処理性能の向上や安定化につながると期待している。つまり条件毎の処理性能を確認するだけでなく、生物処理メカニズムを理解することで、処理がより向上・安定化する条件を理論的に明らかにしていくことができると考えている。
| <参考文献> |
| 1) |
須藤隆一、稲盛悠平:図説 生物相からみた処理機能の診断、 産業用水調査会 |
| 2) |
中村和憲、関口勇地:微生物相解析技術 目に見えない微生物を遺伝子で解析する、米田出版 |
| 3) |
Rotthauwe et al:The ammonia monooxygenase structural gene amoA as a functional marker: molecular fine-scale analysis of natural ammonia-oxidizing populations. Appl Environ Microbiol 63:4704、1997. |
| 4) |
小泉嘉一、水谷篤、三井綾子、吉村義隆、福井学:浄化槽の処理プロセスにおける真正細菌群集の変性剤濃度勾配ゲル電気泳動法による長期間モニタリング、水環境学会誌31巻2号、2008. |
| 5) |
清原洋太、荒谷裕治、鈴木栄一:生物膜法における水温変動が窒素除去に与える影響と微生物群集構造、日本水環境学会講演集45th p649、2011. |
|
| |
| (フジクリーン工業(株) 第二開発部) |
| |
 |
 |